
綠谷醫藥的阿爾茨海默病藥物甘露特鈉膠囊
8月12日,國家藥監局政務服務門戶網站發布了兩條信息送達告訴,其間綠谷醫藥的阿爾茨海默病藥物甘露特鈉膠囊(俗稱“971”“九期一”),出現在“藥品告訴件送達信息”中,而非“藥品同意證明文件送達信息”。
有業界人士剖析指出,這表明971再注冊請求未獲同意。洶涌新聞記者注意到,有醫藥職業數據庫顯現,971的審評狀況為“已審評”,審評狀況為企業撤回/暫未同意等。
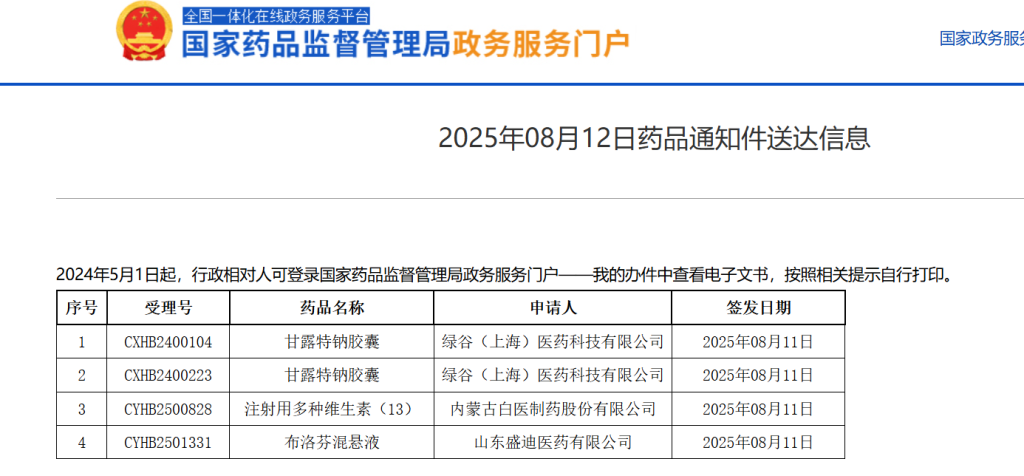
國家藥監局的告訴件送達信息
關于971未被同意的音訊是否事實,一位綠谷職工稱,自己還沒接到告訴。
971于2019年11月在我國取得附條件上市,用于醫治輕中度阿爾茨海默病。該藥是以海洋褐藻提取物為質料,制備取得的低分子酸性寡糖化合物,是首個靶向腦腸軸機制的阿爾茨海默病新藥。在開端獲批時,綠谷制藥稱,971從開端研發到獲批上市歷時22年,僅三期臨床研討就花了4年時刻,填補了阿爾茨海默病范疇17年無新藥上市的空白。
在被部分人奉為“阿爾茨海默病神藥”的一起,該藥的效果機制、臨床實驗數據、效果等也廣受質疑。最有名的是前首都醫科大學校長饒毅與971的首要發明人——我國科學院上海藥物研討所耿美玉的揭露評論。饒毅揭露發文亞洲妞妞在線稱:“假如971是真藥而不是假藥,只能說做真藥只需要走街串巷的功夫”。
兩邊除了隔空對話之外,還打起了名譽權官司。據饒毅于2023年7月13日發布的文章,2021年,上海浦東新區人民法院一審駁回耿美玉訴訟請求;2023年,上海市榜首中級人民法院二審駁回耿美玉上訴,“本判定為終審判定”。依照饒毅的說法,其時也在一審進程的耿美玉方提出寬和,饒方不同意。一審耿美玉敗訴。耿方不服一審判定而上訴后,再次敗訴。
從揭露信息來看,綠谷醫藥期望經過更多研討成果以及海外商場的批閱發展來證明971的有效性和安全性。2020年4月8日,971世界多中心3期臨床研討請求獲美國FDA同意。其時,綠谷曾稱要在五年內進行新藥全球注冊申報。2022年5月,綠谷宣告中止了甘露特鈉的世界三期臨床實驗。這一動作成為部分業界人士以為971效果存疑的信號,但綠谷醫藥方面給出的解說是疫情、資金等要素的影響。
業界的爭議并未影響971的臨床使用。2021年末,該藥經過醫保商洽進入國家醫保目錄,價格降亞洲妞妞在線到296元/盒。由于開端同意是附條件,國家藥監局其時要求綠谷制藥在上市后繼續進行藥理機制方面的研討和長時間安全性有效性研討,完善寡糖的剖析辦法,準時提交有關實驗數據。揭露信息顯現,綠谷在2024年5月開端向國家藥監局遞送資料,請求新的答應批件。2024年10月,監管部門要求綠谷進一步提交彌補資料。
本年5月,有網友在交際途徑發布求助信息稱:“家中親人常服的甘露特鈉膠囊(九期一)在醫院買不到了。”5月19日,綠谷方面曾在官方大眾號發布音訊稱:“咱們連續收到各地患者關于甘露特鈉膠囊‘購藥難’的狀況,以及單個購藥途徑急速提價。咱們深知用藥中止會對病況發生嚴重影響,對此咱們深表遺憾。咱們正與有關部門親近交流,盡心竭力處理相關供貨問題,以趕快滿意患者的火急醫治需求。”但該內容之后已被刪去。
業界普遍以為,上述“購藥難”是由于971的藥品注冊證到期。綠谷醫藥在本年5月30日的內部告訴在職業廣為流傳,依照告訴,971產品線的相關崗位罷工停產,由于甘露特鈉的藥品注冊證到期,正在等候藥監局批閱成果。